
自2020年新冠疫情以來,我國各黨政軍群機關、企事業單位和廣大人民群眾積極抗疫,堅守自己職業的“責任田”,努力恢復生產生活秩序,取得抗擊新冠疫情斗爭重大戰略成果。
此次疫情,國家藥監局及時啟動了醫療器械應急審批程序,應急審批了43種診斷試劑盒和一大批疫情防控所需醫療器械滿足疫情防控需要,呼吸機、心電圖機、CRP、消毒產品線、霧化器、血氧儀等醫療器械需求量暴漲。疫情控制后,原《醫療器械監督管理條例》已難以滿足新形勢需要,于2021年2月9日正式公布新條例。
新《醫療器械監督管理條例》四大關鍵方向解讀
新條例將醫療器械創新納入發展重點,圍繞落實注冊人、備案人制度,強化企業主體責任、鼓勵行業創新發展、提高監管效能及違法成本四大核心要點進行修訂。
一、落實注冊人,備案人制度
——嚴謹的標準是行業發展的壓艙石
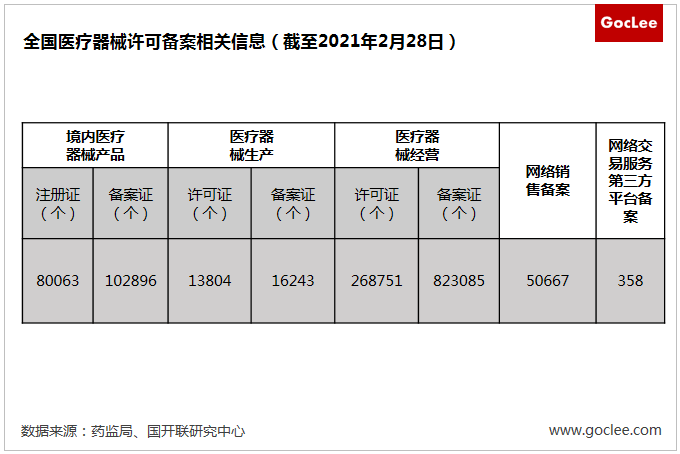
落實第一責任人。落實注冊人,備案人制度,實質就是要求醫療器械研制、生產、經營、使用全過程中的安全性、有效性責任承擔明確到人。截至2020年10月,全國已有552個產品按照醫療器械注冊人制度試點獲準上市,并有近900個產品按照醫療器械注冊人制度申請辦理注冊。充分反映出產業對這項制度的強烈需求。
——注冊人制度釋放紅利
有利于資源配置。實施注冊人制度落實后,注冊人需要對產品全生命周期進行負責。若產業過于分散,則不便于管理并浪費大量資源。因此企業需調整產業布局,將人力資源、交通運輸成本、原材料費用等納入布局范圍,優化資源配置。
有助于優化產業結構。目前醫療器械產業分散、企業普遍規模小,實行注冊制度后,產業集中度將提高,落后產能進一步減少,助推產業結構調整和實現高質量發展。
二、落實改革舉措,鼓勵行業創新發展
——國內醫療器械產業結構亟需改革
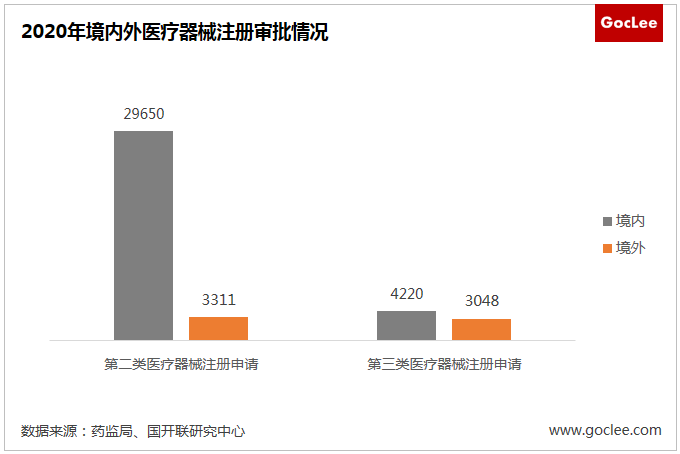
國內多數醫療器械生產企業集中在中低端市場,高端器械仍依賴于進口。截至2020年8月底,全國實有醫療器械生產企業26456家,比去年增長四成,其中90%的企業收入不足2,000萬元,大多為小規模生產企業。在高端器械方面,2020年,境內第三類醫療器械注冊受理共4220項,與2019年相比增加20.2%,進口第三類醫療器械注冊受理共3048項,與2019年相比增加20%,高端器械行業仍依賴于進口。
——全面激發社會創新活力
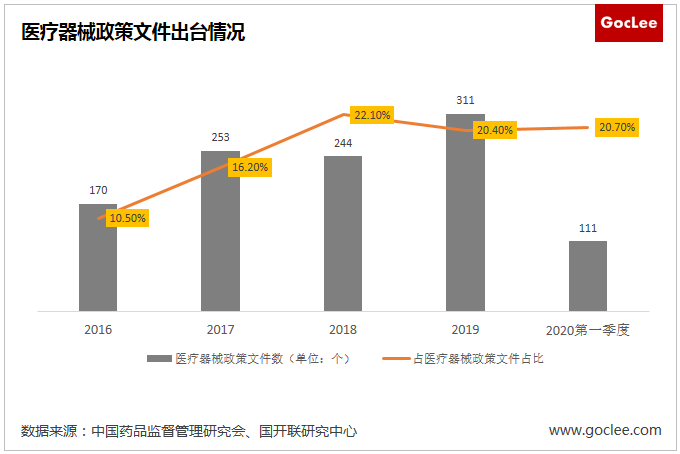
國家對醫療器械行業愈發重視。從國家和地方出臺的醫藥行業政策文件來看,2016年、2017年、2018年、2019年出臺的醫療政策文件數分別是170個、253個、244個、311個,在醫藥行業政策文件占比分別是10.5%、16.2%、22.1%、20.4%。其中,2020年僅第一季度就出臺醫療器械政策文件111個,占比20.7%,體現國家對醫療器械行業的高度重視。
醫療器械創新納入發展重點。新條例在科技立項、融資、信貸、招標采購、醫保等方面予以全面支持,鼓勵醫療器械行業提高自主創新能力。
支持開展合作創新。支持企業設立或者聯合組建研制機構,鼓勵企業與高等院校、醫療機構合作開展創新。
表彰貢獻單位或個人。對在醫療器械的研究與創新方面作出突出貢獻的單位和個人給予表彰獎勵。
——優化審批程序、完善審評審批制度
減輕企業負擔。允許企業提交自檢報告,減少審批材料;將生產經營許可審查期限由30個工作日縮短為20個工作日;延續注冊和臨床試驗實行默示許可。
創新項目優先審評審批。對創新醫療器械優先審評審批,2020年收到優先審批申請22項,其12項獲準優先審批。
提高應對突發事件能力。增加醫療器械緊急使用制度,提高應對重大突發公眾衛生事件能力等,為醫療器械行政許可、備案等提供便利,規定出現特別重大突發公共衛生事件或者其他嚴重威脅公眾健康的緊急事件,可以在一定范圍和期限內緊急使用醫療器械。
三、優化監管制度設計,提升監管效能
——有效提升監管效能
加強隊伍建設。要求2020年底,監管部門基本完成職業化專業化檢查員隊伍體系建設。
實施標識追溯。分步實施醫療器械唯一標識制度,實現醫療器械可追溯。利用唯一標識,準確定位問題器械,實現存在質量風險的醫療器械快速精準召回,并可實現醫療器械生產、經營、使用各環節的透明化、可視化,防止假冒醫療器械流入市場,有利于凈化市場、優化營商環境。
增加責任約談制度。擁有行政職權的行政主體,約見未履行職責或履行職責不到位的下級組織或者行政相對人,糾正并規范不當行為的工作制度。
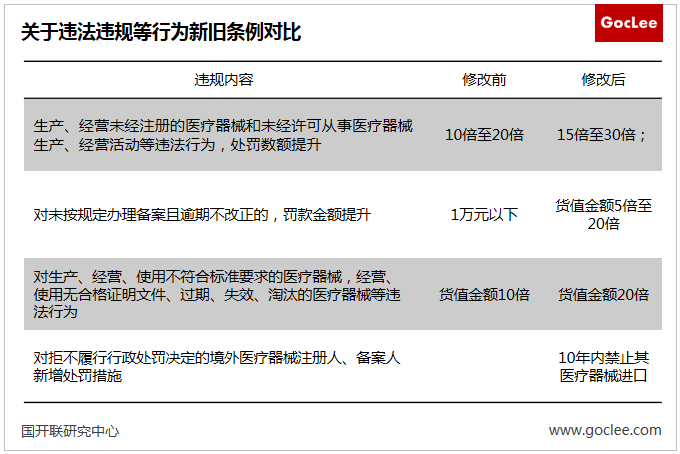
四、細化違法情形,加大懲處力度
——加大了對違法違規行為的處罰力度
處罰落實到人。實行同時針對企業和企業有關責任人員的“雙罰制度”,處罰方式包括沒收違法行為發生期間自本單位所獲收入,最高可并處3倍罰款,禁止其5年直至終身從事醫療器械生產經營活動。
提高違法違規成本。新條例加大對違法違規懲處力度,具體表現如下圖。
醫療器械行業發展趨勢
自2015年以來,醫療器械行業的年均增長率保持在20%左右,連續超越GDP的增速,市場規模也從2006年的434億元增長至2019年的6000余億元,2020年新冠疫情的爆發更是令醫療器械行業迎來數輪投資高潮,據中國醫療器械行業協會預計,未來5年國內復合增長還將達到15-20%左右,業內認為,醫療器械行業將迎來“黃金發展十年”。
高端醫療器械或為下階段熱點。目前,伴隨人口老齡化趨勢加大、醫療保險制度的完善、國產醫療器械支持政策的不斷出臺及群眾醫療需求的不斷提高,高端醫療器械有望助力精準醫療,成為下一個熱點。
醫療器械行業集中度將不斷提高。伴隨注冊制的推出,企業會更傾向于優化資源配置,做大企業規模,將產業集中化。加之目前國內醫療器械大多以小規模企業為主,未來若要占據市場規模,集中產業、整合并購是有效的路徑。
國產醫療器械扶持力度逐漸加大。目前國內大部分醫療器械仍依賴于進口,由多部委給予的國產醫療器械扶持政策不斷出臺,國產創新性產品會越來越多,進出口總額將進一步增加,同時出口醫療器械的品種結構也將逐步改善。
小結
醫療器械作為醫療行業中十分優質的賽道,始終保持著良好的發展態勢。但目前仍面臨著諸多挑戰,如高端器械行業仍依賴于進口、醫療產業不集中等問題。伴隨新《條例》法規政策的完善、審評審批制度的深化改革、更大力度的監管,醫療器械行業將迎來高速發展和創新驅動兩大趨勢共存的時代。
生物醫藥與健康產業招商圖譜(招商地圖)系列
2025.06.12面議元.醫藥健康
按照“4.0版招商地圖”的研究邏輯,綜合推出的一款“普惠型招商地圖”產品。
中醫藥行業研究報告(綜合) 2024
2024.01.0529800元.生命健康
《報告》重點由中藥材種植、中藥制造和中醫大健康服務三大部分組成,全面呈現中醫藥行業投資價值與未來趨勢。
中山推進粵港澳大灣區建設產業發展規劃 國開聯.區域產業規劃 中山作為灣區重要節點城市,如何搶抓政策紅利,爭建灣區戰略性平臺,承接中心城市轉移產業,共享中心城市產業創新要素資源與平臺,以達至中山“灣...
寧夏先進制造業招商行動計劃 國開聯.招商圖譜與項目包裝 我單位受托制定寧夏全區先進制造產業招商行動計劃,深度剖析全區智能制造產業基礎、結構和產業承載優勢,明確自治區智能制造產業發展方向與未來招...
九省市如何借招商地圖(圖譜)實施專業招商? 國開聯.產業鏈招商與鏈長制 產業招商引資專業化、精細化、市場化已漸成業界共識,然而,如何實施專業化招商,如何進行精細化部署,又如何借助市場化的手段來提高招商引資實效...
產業鏈招商圖譜與招商地圖,區別在哪里? 國開聯.產業鏈招商與鏈長制 招商工作越來越趨于專業化、精準化和市場化,招商從業者也越來越意識到產業招商專業化的重要性。
招商引資項目評估 國開聯.產業鏈咨詢 第三方獨立評估,助力項目落地。
戰略新興產業規劃編制 國開聯.熱點議題 我們的成功案例遍及全國30省(區、市),連續獲得客戶信賴和委托。